С 1 января 2020 года в России вводится обязательная маркировка лекарственных препаратов
Руководитель Территориального органа Росздравнадзора по Архангельской области и Ненецкому автономному округу Виктор Стародубенко обозначил изменения для юридических лиц и предпринимателей с 1 января 2020 года.
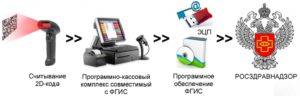
С 1 января 2020 года юридические лица и индивидуальные предприниматели, осуществляющие обращения лекарственных средств (производство, хранение, ввоз в Российскую Федерацию, отпуск, реализацию, передачу, применение и уничтожение лекарственных препаратов для медицинского применения), т.е. имеющие лицензию на медицинскую и/или фармацевтическую деятельность, должны обеспечить внесение информации о лекарственных препаратах в систему мониторинга движения лекарственных препаратов для медицинского применения.
В связи с вступлением в силу Федерального закона от 28.12.2017 № 425-ФЗ «О внесении изменений в Федеральный закон «Об обращении лекарственных средств», и в соответствии с частью 7 статьи 67 Федерального закона от 12.041.2010 № 61-ФЗ «Об обращении лекарственных средств».
Обращаем внимание, что организации и индивидуальные предприниматели, не подключившиеся в информационной системе мониторинга движения лекарственных препаратов, не смогут осуществлять обращение лекарственных препаратов, имеющих маркировку контрольными (идентификационными) знаками DataMatrix, с указанной даты.

По словам руководителя Территориального органа Росздравнадзора по Архангельской области и Ненецкому автономному округу Виктора Стародубенко, основные цели маркировки и системы мониторинга движения лекарственных препаратов следующие (далее – система МДЛП):
Для государства:
- Профилактика поступления в оборот и одномоментное изъятие из оборота в автоматизированном режиме на всей территории Российской Федерации недоброкачественных, а также фальсифицированных и контрафактных лекарственных препаратов на любом из этапов их обращения от производителя до конечного потребителя;
- Профилактика неэффективных расходов и экономия бюджетных средств за счет невозможности реализации схем «повторного вброса» лекарственных препаратов, невозможности легальной реализации лекарственных препаратов, подлежащих предметно-количественному учету, а также не предназначенных для розничной продажи;
- Контроль адресности движения препаратов, закупаемых за счет бюджета, расходов на их приобретение; мониторинг ценообразования и предельных розничных цен на лекарственные препараты из списка ЖНВЛП;
- Оперативное планирование и управление запасами и резервами препаратов на всех уровнях, включая стратегический.
Для населения:
- Возможность с помощью персонального мобильного устройства лично проверить легальность приобретаемого (получаемого) лекарственного препарата.
Для бизнеса:
- Снижение издержек за счет более эффективного управления логистикой; уменьшение упущенной выгоды, обусловленной контрафактной и фальсифицированной продукцией; соответствие требованиям для поставок продукции на международные рынки.
Напомним, порядок внесения информации о лекарственных препаратах в ФГИС МДЛП и ее состав регламентирован Положением о системе мониторинга движения лекарственных препаратов для медицинского применения, утвержденным постановлением Правительства Российской Федерации от 14.12.2018 № 1556.
Информация по внедрению системы мониторинга движения лекарственных препаратов размещена и регулярно обновляется на официальном сайте Росздравнадзора в разделе «Система маркировки лекарственных препаратов», на сайте архангельского территориального органа и на официальном сайте оператора системы Центра развития перспективных технологий «Честный знак».
Виктор Стародубенко отметил, что срок внедрения маркировки лекарственных препаратов переноситься не будет.
С 1 января 2020 года все субъекты обращения лекарственных препаратов в обязательном порядке должны быть зарегистрированы в системе мониторинга движения лекарственных препаратов и вносить в нее необходимую информацию.
Подчеркнем, что согласно утвержденного постановления, если организация имеет лицензию на медицинскую деятельность и осуществляет деятельность по оказанию работ и услуг по стоматологии регистрироваться в системе по маркировке лекарственных средств нужно.
Регистрацию в Федеральной государственной информационной системе мониторинга движения лекарственных препаратов для медицинского применения (ФГИС МДЛП) необходимо пройти на сайте Центра развития перспективных технологий «Честный знак».
Обучение персонала по работе в системе МДЛП осуществляется в территориальных «Центрах компетенций». Перечень таких центров опубликован на сайте Росздравнадзора.
В Архангельской области эффективно работают два Центра компетенций на базе:
- ГУПАО «Фармация» (8182) 63-60-40,
заявку направить на эл. адрес: mdlp@aptekaf.ru - ГБУЗ АО «Архангельская областная клиническая больница» (8182) 63-63-09,
заявку направить на эл. адрес: apteka@aokb.ru
Контроль за обращением лекарственных препаратов
За производство или продажу лекарственных препаратов для медицинского применения без нанесения средств идентификации, с нарушением установленного порядка их нанесения, а также за несвоевременное внесение данных в систему мониторинга движения лекарственных препаратов для медицинского применения или внесение в нее недостоверных данных юридические лица и индивидуальные предприниматели несут ответственность в соответствии с законодательством Российской Федерации.
В соответствии со статьей 1 Федерального закона от 15.04.2019 № 58-ФЗ «О внесении изменений в Кодекс Российской Федерации об административных правонарушениях» (начало действия статьи 6.34 КоАП с 1 января 2020 года) несвоевременное внесение в систему мониторинга движения лекарственных препаратов – влечет наложение административного штрафа на должностных лиц в размере от 5 тысяч до 10 тысяч рублей; на юридических лиц – от 50 тысяч до 100 тысяч рублей.
За административные правонарушения, лица, осуществляющие предпринимательскую деятельность без образования юридического лица, несут административную ответственность как юридические лица.
Также обращаем внимание, что согласно пункту 2 статьи 15.12 «Кодекса Российской Федерации об административных правонарушениях» от 30.12.2001 № 195-ФЗ продажа товаров и продукции без маркировки и (или) нанесение информации, предусмотренной законодательством Российской Федерации, в случае, если такая маркировка и (или) нанесение такой информации обязательны, а также хранение, перевозка либо приобретение таких товаров и продукции в целях сбыта, за исключением продукции, указанной в части 4 настоящей статьи, влечет наложение административного штрафа:
- На граждан в размене от 2 тысяч до 4 тысяч рублей с конфискацией предметов административного правонарушения;
- На должностных лиц – от 5 до 10 тысяч рублей с конфискацией предметов административного правонарушения;
- На юридических лиц – от 50 тысяч до 300 тысяч рублей с конфискацией предметов административного правонарушения.
Дела об административных правонарушениях, предусмотренных статьей 6.34 КоАП, будет рассматривать Федеральный орган исполнительной власти, осуществляющий функции по контролю и надзору в сфере здравоохранения, его территориальные органы.